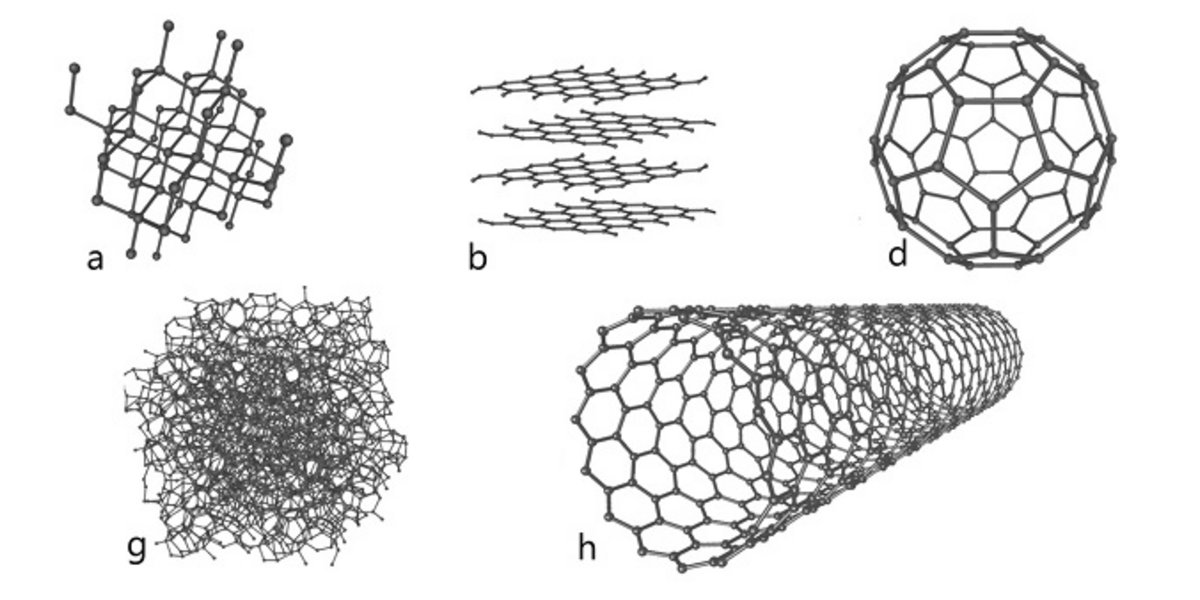
Die Masse des gesamten Kohlenstoffs auf der Erde wird auf 20'000 bis 50'000 Milliarden Tonnen geschätzt. Er kommt in den meisten Ozeanen (74%) in Form von Karbonat-Ionen und Bikarbonaten vor sowie in fossiler Form in den Überresten toter Organismen (22%), in lebenden Organismen (3%) und in der Atmosphäre (1%).
Mit seinen einzigartigen Eigenschaften, insbesondere der Fähigkeit, einfache Zwei- und Dreifach-Verbindungen mit sich selbst einzugehen, ist Kohlenstoff die Grundlage des wahrscheinlich komplexesten physikalischen Phänomens: des Lebens.
Alle lebenden Organismen, von Pflanzen und Tieren über Bakterien bis hin zu Pilzen, bestehen in ihren fundamentalen Verbindungen aus auf Kohlenstoff basierenden Molekülen: aus Proteinen, Lipiden, Kohlenhydraten, Nukleinsäuren.
Ursprung der Kohlenstoffatome
Im Universum entstehen Kohlenstoffatome ursprünglich in den Sternen durch die Fusion von drei Heliumatomen (Ordnungszahl 2) zu einem Kohlenstoffatom (Ordnungszahl 6). Im Kosmos ist Kohlenstoff in Bezug auf seine globale Masse das vierthäufigste Element nach Wasserstoff, Helium und Sauerstoff.