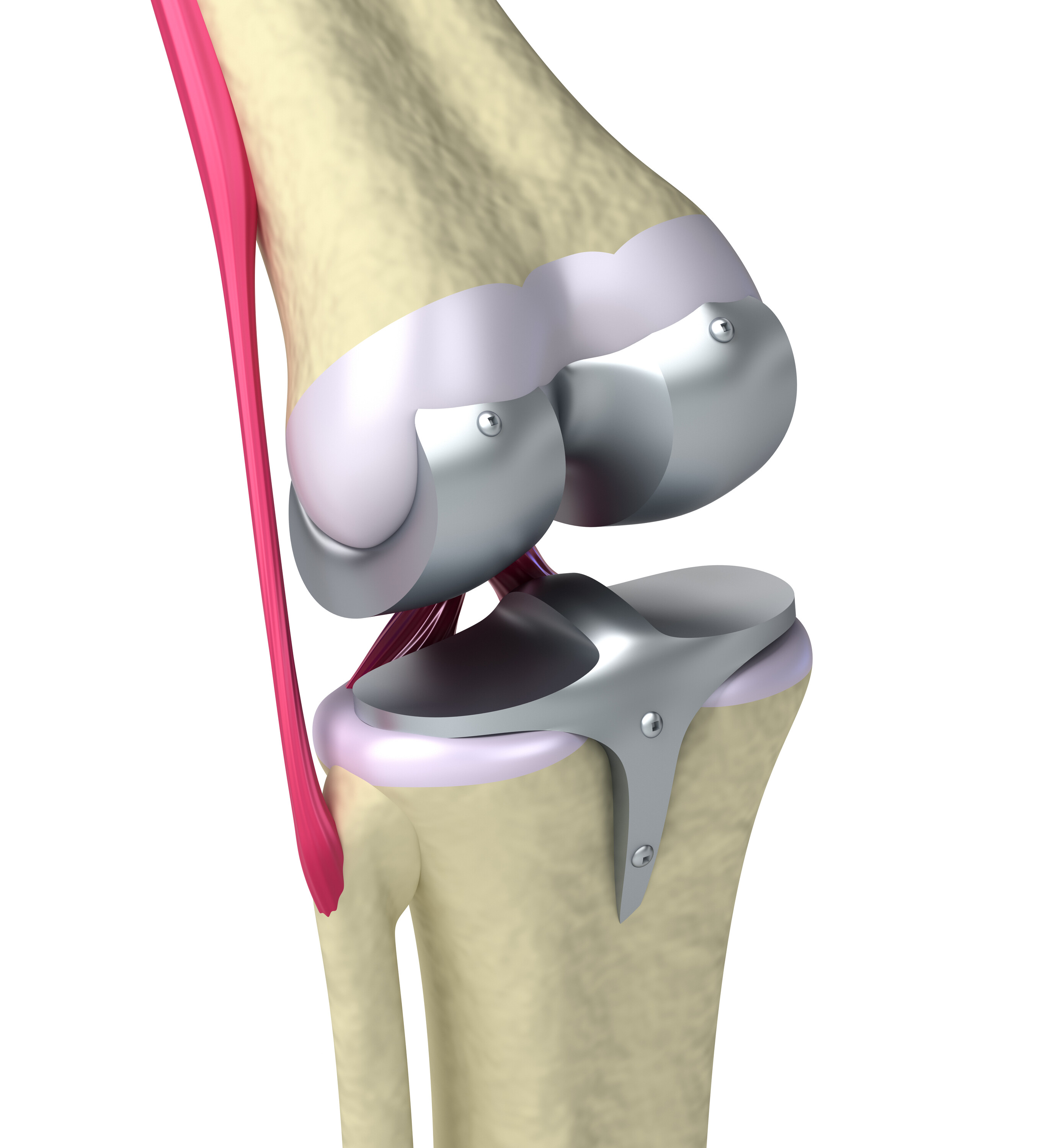
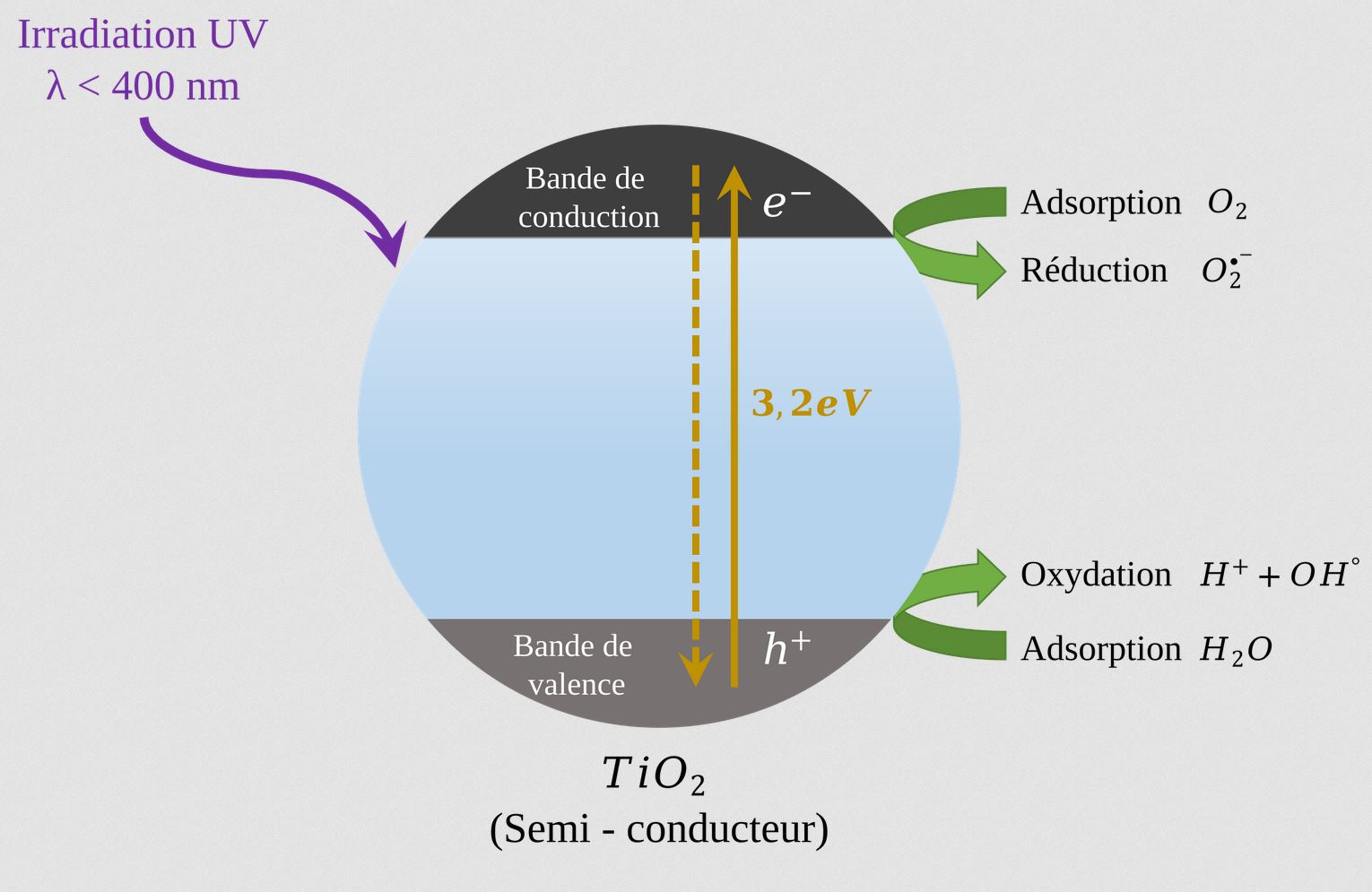
A quoi ressemble le titane ?
Le titane est un métal léger (densité 4.51) et dur qui ressemble à l’aluminium, et comme lui, il est recouvert d’une couche d’oxyde étanche, imperméable et très adhérente. Cette couche protectrice se reforme au contact de l’air en cas de rayure. Son aspect blanc, brillant et inaltérable est apprécié pour la fabrication de bagues et bijoux.
L’isolation de ce métal, un procédé compliqué…
Le titane est l’un des éléments les plus abondants de la croûte terrestre, mais aussi l’un de ceux qu’on a eu le plus de peine à isoler. Pratiquement toutes les roches contiennent environ 1% de son oxyde TiO2. Le principal minerai de TiO2, est une pierre semi-précieuse dite rutile, à cause de sa couleur rouge mais très rare sur Terre. Pour cela, on extrait le titane d’un minéral plus courant, l’ilménite FeTiO3 en chauffant un mélange de TiO2 (ou de FeTiO3) et de charbon dans un courant de chlore Cl2. Cette réaction produit TiCl4 qui est un liquide bouillant à 136°C. Ce chlorure réagit très facilement avec l’eau et l’air humide en formant un brouillard opaque de TiO2 et d’acide chlorhydrique (HCl), capable de dissimuler tout un régiment de chars en déplacement dans la campagne. On transforme ensuite TiCl4 en titane métallique par réaction avec du magnésium métallique fondu. Mais il faut travailler sous vide, ou dans une atmosphère d’argon, pour éviter le contact de l’air humide qui reformerait TiO2. Ce procédé est loin d’être facile !