La découverte du zinc
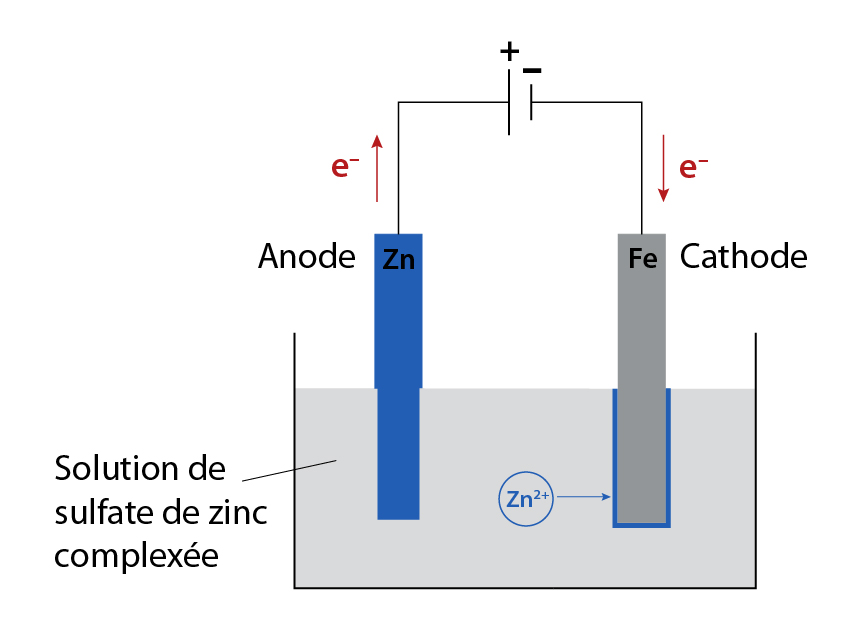
Le zinc a été découvert par l’alchimiste suisse Paracelse, mais il a été isolé pour la première fois à l’état métallique par l’Allemand Andreas Marggraf en 1754, qui l’a extrait d’un silicate naturel de zinc dit « calamine ». Le zinc est un métal blanc bleuâtre utilisé comme agent de protection du fer ou d’acier contre la rouille en les recouvrant. Cette opération peut se faire soit par galvanoplastie (électrolyse d’une solution de sulfate de zinc complexée) soit par immersion de l’objet en fer dans un bain de zinc fondu à 500°C. Avec de la tôle de fer, on obtient le fer-blanc, dont on fait des tôles utilisées pour recouvrir les granges ou les maisons. La protection du fer-blanc contre la rouille est bonne tant qu’il n’y a pas de rayures, ou tant qu’il n’y a pas un morceau d’un autre métal au contact du zinc. Dans ce cas, il se forme un phénomène de pile qui détruit rapidement le zinc.