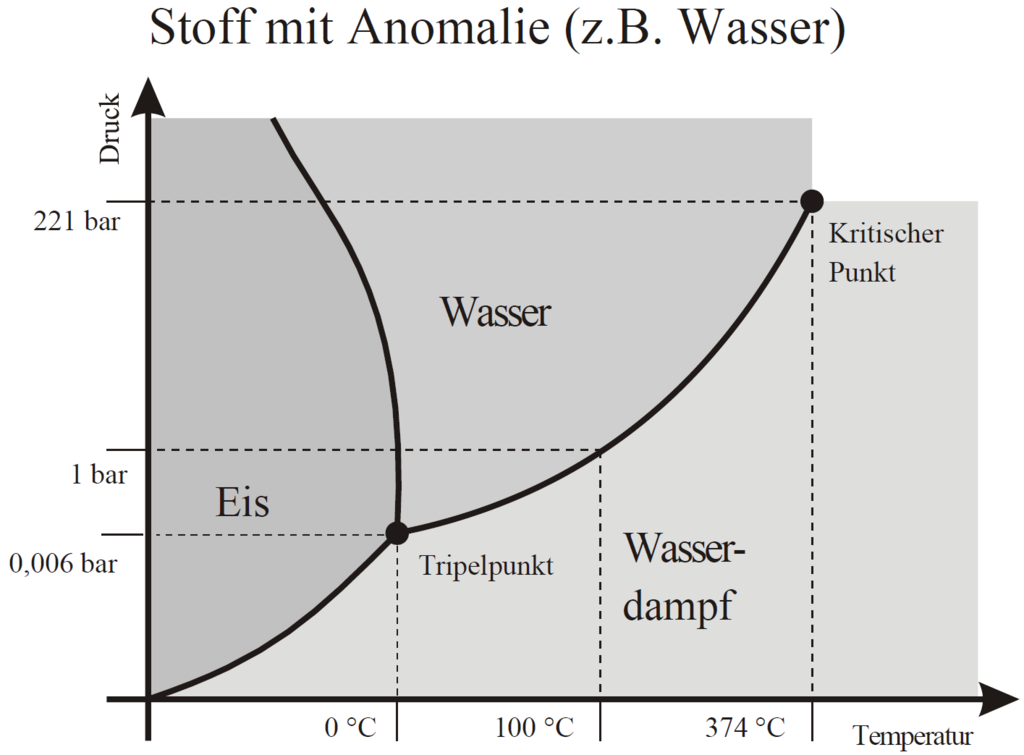
Ob Wasser fest, flüssig oder gasförmig ist, hängt nicht nur von der Temperatur ab, sondern auch vom Druck. Die einzelnen Moleküle im Wasser (wie auch in jeder anderen Flüssigkeit) sind ständig in Bewegung. Wenn die Temperatur erhöht wird, bewegen sie sich stärker und schneller. Bei Temperaturen um den Siedepunkt herum (also wenn das Wasser kocht) gelingt es immer mehr Molekülen an der Wasseroberfläche, in die Luft zu entweichen. Die Anziehungskraft zwischen den Teilchen ist dann nämlich nicht mehr ausreichend, um alle Teilchen in der Flüssigkeit zusammenzuhalten. Das Wasser wird gasförmig: Es wird zu Wasserdampf. Dies passiert nicht nur an der Wasseroberfläche, sondern überall in der Flüssigkeit, wo sich genügend schnelle Moleküle zusammentun. Auch am Boden des Kochgefässes siehst du zum Beispiel, wie sich kleine Gasblasen bilden und aufsteigen.
Teilchen in Bewegung kämpfen gegen den Druck
Der Druck, der aus der Bewegung (also der Temperatur der Moleküle) entsteht, hat jedoch einen Gegenspieler: den Druck der Luft, die sie umgibt. Die Luftmoleküle möchten ja ebenfalls genügend Platz haben und verteidigen ihr Areal. Die gasförmigen Wassermoleküle werden somit zu einem gewissen Teil wieder in die Flüssigkeit gedrückt. Dies führt zu einem Gleichgewicht, das sich sehr einfach in die eine oder andere Richtung verschieben lässt.
Bei einem Luftdruck von 1.013 bar, was als Normaldruck bezeichnet wird, verdampft Wasser bei 100°C. Der Luftdruck in den Bergen ist kleiner als am Meer, und das Wasser siedet darum bereits bei tieferer Temperatur. Auf dem Mount Everest beträgt der Luftdruck aufgrund der grossen Höhe mit 0.326 bar nur knapp ein Drittel des Normaldrucks, und Wasser siedet dort bereits bei 71°C. Auch in der Schweiz kann man Wasser bereits bei 85°C kochen. Dazu reicht es, auf einen der höchsten Schweizer Berge zu klettern und auf 4500 Meter bei ca. 0.577 bar den Gaskocher zu entfachen.
Allerdings heisst das nicht, dass auch das Kochen dann schneller geht. Im Gegenteil, man muss länger auf sein Essen warten, da die Rüebli, Eier, Teigwaren, usw. bei nur 85°C gegart werden müssen. Da darf man sich nicht wundern, wenn das 3-Minuten-Ei nicht in 3 Minuten fertig ist ...