Chlor kommt in der Natur nicht in reiner Form vor, fällt aber in grossen Mengen bei industriellen Prozessen an. Man gewinnt es zum Beispiel aus einer wässrigen Lösung von Kochsalz, und zwar durch Elektrolyse. Bei diesem Prozess setzt man Strom ein, um eine sogenannte Redoxreaktion auszulösen. Dabei tauschen die Teilchen in der Lösung Elektronen aus und setzen sich zu neuen Molekülen zusammen.
Bei der Elektrolyse von Kochsalz in Wasser, die du in ganz kleinem Massstab auch zuhause durchführen kannst, sind folgende Stoffe beteiligt:
- Wasser: H2O
- Kochsalz (Natriumchlorid): NaCl
- Wasserstoff: H2
- Chlor: Cl2
- Natriumhydroxid: NaOH (in Wasser gelöst bildet es Natronlauge)
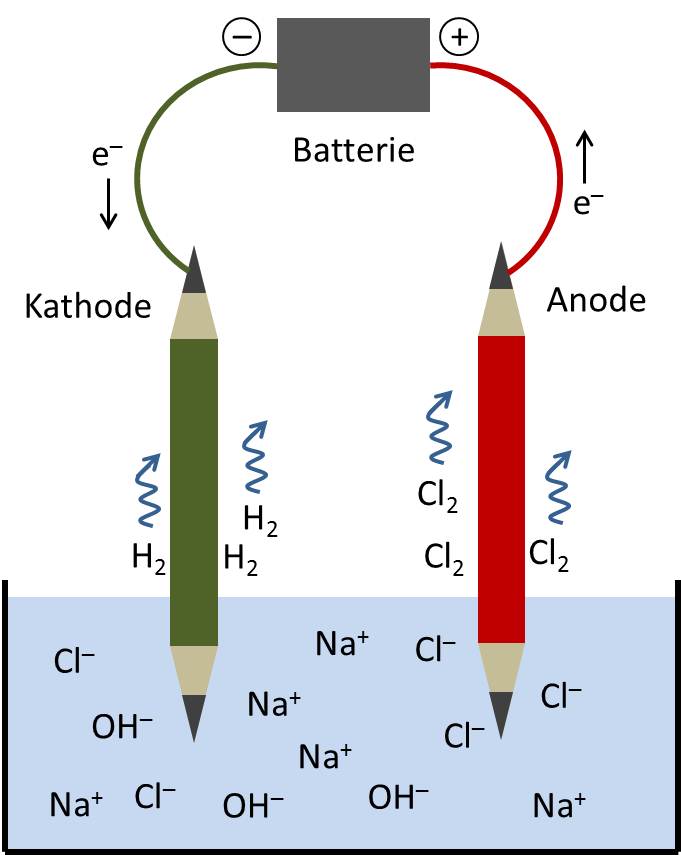
Kochsalz löst sich im Wasser auf, und die Chlor- und Natriumteilchen schwimmen dann als negativ geladene Chlor-Ionen (Cl-) und positiv geladene Natrium-Ionen (Na+) herum. Wenn man nun zwei Elektroden – hier dargestellt durch zwei mit einer Batterie verbundene Bleistifte – in die Lösung taucht, fliesst ein Strom. Die Chlor-Ionen nehmen am Stromkreislauf teil: Sie sammeln sich an der Anode, geben dort ein Elektron (e-) ab und bilden jeweils zu zweit ein Chlor-Molekül (Cl2), das als Gas aufsteigt. Gleichzeitig gelangen an der Kathode Elektronen in die Lösung und werden vom Wasser (H2O) aufgenommen; Wasserstoff (H2) entweicht als Gas und Hydroxid-Ionen (OH-) verbleiben zusammen mit den Natrium-Ionen in der Lösung. Sie bilden eine verdünnte Natronlauge.
Die gesamte Elektrolysereaktion lautet:
2 NaCl + 2 H2O → 2 NaOH + H2 + Cl2