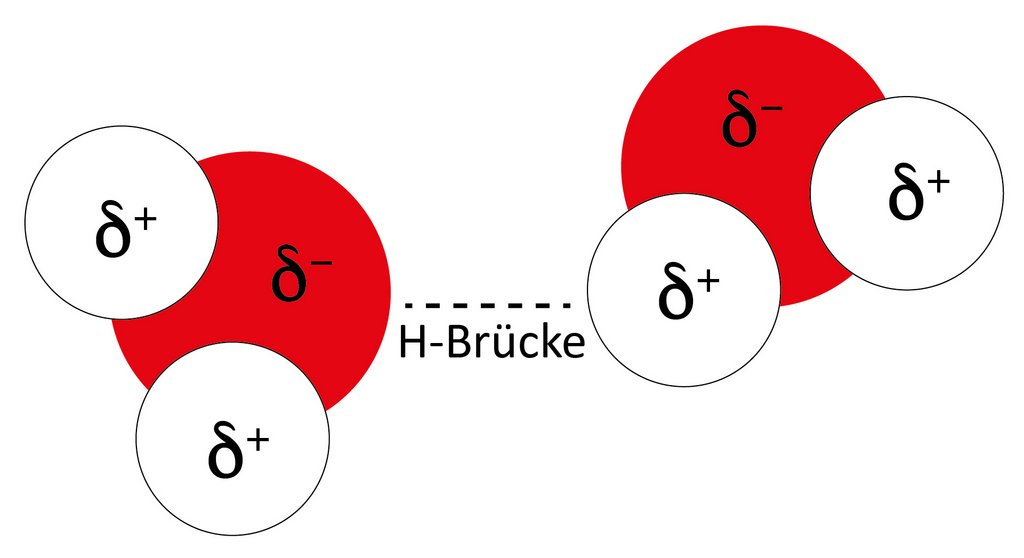
Wasser setzt sich aus winzigen Bauteilchen zusammen: aus einem Sauerstoffatom (O) und zwei Wasserstoffatomen (H). Zusammen bilden sie ein Wassermolekül. Dessen chemische Formel ist H2O. Das Wassermolekül sieht ein bisschen aus wie ein runder Kopf mit zwei Ohren, die in einem Winkel von 104 Grad zueinanderstehen. Stark vereinfacht kann man sagen: Dieser Anordnung verdankt das Wasser seine besonderen Eigenschaften. Sie macht das Wassermolekül zu einem sogenannten Dipol mit einem leicht positiv und einem leicht negativ geladenen Ende. Weil sich negative und positive Ladungen anziehen, halten die Wassermoleküle zusammen – stärker als die Teilchen in chemisch ähnlichen Stoffen. Um sie auseinanderzubringen ist also mehr Energie nötig. Das erklärt, warum Wasser einen hohen Schmelz- und Siedepunkt hat: Eis schmilzt erst bei 0°C und Wasser verdampft bei 100°C.
Eine weitere Besonderheit des Wassers ist seine Dichteanomalie: "Normale" Stoffe werden beim Abkühlen immer dichter, ihre kleinsten Teilchen rücken umso näher zusammen, je kälter es wird. Beim Wasser stimmt das nur bis 4°C. Darunter dehnt es sich wieder aus. Deshalb hat Eis ein grösseres Volumen und ist leichter als Wasser. Und deshalb zerplatzen im Tiefkühler vergessene Wasserflaschen.